TEORIA ISE
Potencjał elektrody
W roztworze elektrody jonowoselektywne wytwarzają potencjał, który jest proporcjonalny do logarytmu aktywności badanego jonu. Wartość tego potencjału jest określona za pomocą równania Nernsta:
E = constant ± 2,303 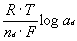 |
(1) |
gdzie
| E = |
potencjał elektrod jonowoselektywnych, mierzony względem zewnętrznej elektrody odniesienia |
| constant = |
pewna wielość, której wartość zależy od rodzaju czujnika elektrody i od wewnętrznego układu odniesienia |
| R = |
stała gazowa |
| T = |
temperatura bezwzględna |
| F = |
stała Faradaya |
| nd = |
ładunek oznaczanego jonu |
| ad = |
aktywność oznaczanego jonu |
Równanie (1) stosuje się jednak tylko wtedy, gdy badane jony są w roztworze. Jeżeli analizowany roztwór zawiera jony, które wywierają większe lub mniejsze zakłócenie na odpowiedź elektrod jonowoselektywnych, wówczas należy stosować równanie zaproponowane przez Nikolskiego:
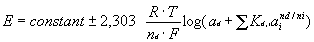 |
(2) |
gdzie:
| ad = |
aktywność oznaczanego jonu |
| aj = |
aktywność jonów zakłócających |
| nd = |
ładunek oznaczanego jonu |
| nj = |
ładunek jonów zakłócających |
| Kd,i |
współczynnik selektywności (omówiony poniżej) |
Wielkość 2,303 RT/F nosi nazwę współczynnika Nernsta, a jej wartość przy temperaturze 25&°C dla jednowartościowego jonu wynosi 59,2 mV. Przedstawiając graficznie zmianę potencjału elektrody w zależności od logarytmu aktywności otrzymuje się linię prostą, której nachylenie dla poszczególnych przypadków badanych jonów jednowartościowych, dwuwartościowych i/lub trójwartościowych przyjmuje wartość odpowiednio 59,2mV, 29,6mV i/lub 19,7mV.
Jak wspomniano powyżej , elektrody jonowoselektywne odpowiadają na aktywność wolnych niezwiązanych jonów. W praktyce jednak częściej wymagane jest oznaczanie zawartości . Możliwe jest również, a w zastosowaniu elektrod jonowoselektywnych nawet bardziej pożądane jest graficzne przedstawienie zmian potencjału, które zależą od zawartości (stężenia) składnika przy stałej mocy jonowej, ponieważ aktywność i zawartość związane są prostą zależnością.
Współczynnik aktywności jonowej
W roztworach zawierających tylko proste niezwiązane jony stosuje się następujące równanie:
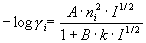
gdzie:
| ai = |
aktywność jonu |
| cn = |
zawartość jonu |
| γi = |
współczynnik aktywności jonowej |
Wartość współczynnika aktywności można ogólnie obliczyć z rozszerzonego równania Debye`a - Hueckel`a:
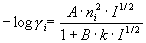 |
(4) |
gdzie:
| I - |
całkowita moc jonowa roztworu ( I= ½ Σcn · ni2 ) |
| A, B = |
stałe, które są zależne od rodzaju roztworu i od temperatury (dla wody przy temperaturze 25°C, S=0,509 i B=0,328) |
| K = |
parametr Kiellanda zależny od skutecznej wartości jonu hydronowego |
Współczynnik aktywności dla różnych jonów i mocy jonowych można określić za pomocą tablic I i II. Tablica I zawiera wartości parametru Kiellanda dla grupy najczęściej spotykanych jonów Tablica II zawiera wartości współczynników aktywności obliczone według równania (4), w zależności od całkowitej mocy jonowej roztworu i od parametru Kiellanda badanego jonu.
Procedura oznaczania jest następująca:
Należy obliczyć moc jonową analizowanego roztworu. W tablicy I znaleźć parametr Kiellanda badanego jonu. Następnie w tablicy II należy znaleźć wartość ?i w kolumnie, która odpowiada obliczonej wartości mocy jonowej, odczytując współczynnik aktywności na linii odpowiadającej znalezionemu parametrowi Kiellanda.
Wartości parametru Kiellanda dla różnych jonów
|
k
|
Jony jednowartościowe
|
|
9
|
H+
|
|
6
|
Li+, benzoesan, salicylan, octan fenylu, czteroetyloamon
|
|
5
|
dwuchlorooctan, trójchlorooctan, trójetyloamon
|
|
4,5
|
Na+, ClO-2, IO-3, HCO-3, HSO-3, H2PO4-, H2AsO4-, octan, chlorooctan, czterometyloamon, dwuetyloamon, glicynian
|
|
4
|
Glicyna, trójetyloamon, etyloamon
|
|
3,5
|
OH-, BrO3-, ClO3-, ClO4-, F-, IO4-, MnO4-, SH-, SCN-, mrówczan, cytrynian pierwotny, dwumetyloamon, metyloamon
|
|
3
|
K+, Br-, CN-, Cl-, I-, NO2-, NO3-
|
|
2,5
|
Ag+, Cs+, NH4+, Rb+, TI+
|
|
Jony dwuwartościowe
|
|
8
|
Be2+, Mg2+
|
|
6
|
Ca2+, Co2+, Cu2+, Fe2+, Mn2+, Ni2+, Sn2+, Zn2+, ftalan, glutaran, adypinian
|
|
5
|
Ba2+, Cd2+, Hg2+, Sr2+, S2-, S2O42-, WO42-, malonian, bursztynian, winian
|
|
4,5
|
Pb2+, CO32-, MoO42-, SO32-, cytrynian wtórny (drugorzędowy), szczawian
|
|
4
|
CrO42-, HPO42-, SO42-, S2O32-, S2O62-, S2O82-, SeO42-
|
|
Jony trójwartościowe
|
|
9
|
Al3+, Cr3+, Fe3+, In3+, Sc3+ i jony metali ziem rzadkich
|
|
6
|
(Co en3)3+
|
|
5
|
Cytrynian trzeciorzędowy
|
|
4
|
[Fe(CN)6]3-, [Co(NH3)6]3+
|
|
Jony czterowartościowe
|
|
11
|
Ce4+, Sn4+, Th4+, Zr4+
|
|
5
|
[Fe(CN)6]4-
|
Wartości współczynników aktywności γi
Obliczone z rozszerzonego równania Debye`a - Hueckel`a dla roztworów wodnych przy temperaturze 25°C.
|
Moc jonowa I
|
|
Parametr
|
0,0005
|
0,001
|
0,0025
|
0,005
|
0,01
|
0,025
|
0,05
|
0,1
|
|
Współczynnik aktywności jonowej ( γi )
|
|
K
|
Jony jednowartościowe
|
|
9
|
0,975
|
0,967
|
0,950
|
0,933
|
0,914
|
0,880
|
0,860
|
0,830
|
|
6
|
0,975
|
0,965
|
0,948
|
0,929
|
0,907
|
0,870
|
0,835
|
0,800
|
|
5
|
0,975
|
0,964
|
0,947
|
0,928
|
0.904
|
0,865
|
0,830
|
0,790
|
|
4,5
|
0,975
|
0,964
|
0,947
|
0,928
|
0,902
|
0,860
|
0,820
|
0,775
|
|
4
|
0,975
|
0,964
|
0,947
|
0,927
|
0,901
|
0,855
|
0,815
|
0,770
|
|
3,5
|
0,975
|
0,964
|
0,946
|
0,926
|
0,900
|
0,855
|
0,810
|
0,760
|
|
3
|
0,975
|
0,964
|
0,945
|
0,925
|
0,899
|
0,850
|
0,805
|
0,755
|
|
2,5
|
0,975
|
0,964
|
0,945
|
0,924
|
0,898
|
0,850
|
0,800
|
0,750
|
|
Jony dwuwartościowe
|
|
8
|
0,906
|
0,872
|
0,813
|
0,755
|
0,690
|
0,595
|
0,520
|
0,450
|
|
6
|
0,905
|
0,870
|
0,809
|
0,749
|
0,675
|
0,570
|
0,485
|
0,405
|
|
5
|
0,903
|
0,868
|
0,805
|
0,744
|
0,670
|
0,555
|
0,465
|
0,380
|
|
4,5
|
0,903
|
0,868
|
0,805
|
0,742
|
0,665
|
0,550
|
0,455
|
0,370
|
|
4
|
0,903
|
0,867
|
0,803
|
0,740
|
0,660
|
0,545
|
0,445
|
0,355
|
|
Jony trójwartościowe
|
|
9
|
0,802
|
0,738
|
0,632
|
0,540
|
0,445
|
0,325
|
0,245
|
0,180
|
|
6
|
0,798
|
0,731
|
0,620
|
0,520
|
0,415
|
0,280
|
0,195
|
0,130
|
|
5
|
0,796
|
0,728
|
0,616
|
0,510
|
0,405
|
0,270
|
0,180
|
0,115
|
|
4
|
0,796
|
0,725
|
0,612
|
0,505
|
0,395
|
0,250
|
0,160
|
0,095
|
|
Jony czterowartościowe
|
|
11
|
0,678
|
0,588
|
0,455
|
0,350
|
0,255
|
0,155
|
0,100
|
0,065
|
|
5
|
0,668
|
0,570
|
0,425
|
0,310
|
0,200
|
0,100
|
0,048
|
0,021
|
Uwaga: Jeżeli moc jonowa jest mniejsza niż 5 ·10-4M., skuteczny współczynnik aktywności będzie równy praktycznie jeden.
Jony zakłócające.
Na ogół przyjmuje się, że jony, które tworzą nierozpuszczalne sole z jonami znajdującymi się w elemencie czujnikowym elektrody, i. lub jony, które tworzą silne związki kompleksowe ze składnikami elementów czujnikowych elektrody, zakłócają odpowiedź elektrody. Na przykład, przy przeprowadzaniu pomiarów za pomocą elektrody chlorkowoselektywnej należy sprawdzić zawartość bromków, jodków, cyjanków i siarczków, ponieważ odpowiednie sole srebra są mniej rozpuszczalne niż chlorek, z którego jest wykonany element czujnikowy elektrody chlorkowej. W podobny sposób należy sprawdzić zawartość cyjanków w roztworach, które mają być analizowane za pomocą elektrody, w której element czujnikowy wykonany jest z siarczku srebra, ponieważ ten element czujnikowy rozpuszcza się powoli w stężonych roztworach cyjanku tworząc kompleksowy związek Ag(CN)2-. Maksymalne stężenie jonów zakłócających, jakie może być obecne w próbce bez powodowania zakłócenia odpowiedzi elektrody jonowoselektywnych, można łatwo obliczyć z wartości iloczynów rozpuszczalności lub ze stałej kompleksowości odpowiednich związków. Stosunek zawartości badanego jonu do maksymalnej dozwolonej zawartości jonu zakłócającego nazywa się współczynnikiem selektywności i oznacza się go przez Kn,xpot gdzie n jest jonem badanym, a x jest jonem zakłócającym.
W większości przypadków współczynników selektywności nie określa się za pomocą obliczenia lecz eksperymentalnie, ponieważ okazało się w praktyce, że ich wartości są zależne od zawartości (stężeń). Metoda obliczeń, która oparta jest na obliczeniu iloczynu rozpuszczalności i stałych kompleksowości, nie uwzględnia tego faktu.
W czasie stosowania elektrod jonowoselektywnych występują jeszcze inne rodzaje zakłóceń. Zakłócenia te wywołują substancje (jony), które są obecne w analizowanych roztworach, które wskutek tworzenia się wydzieleń różnych kompleksowych związków z badanymi jonami zmniejszają ich czynną zawartość w roztworze. Przykładem takich zakłóceń jest zmniejszenie czynnej zawartości fluorków w roztworach zawierających AL3+, w których powstaje związek kompleksowy z jonami AlF63-. Zakłócenia te występują prawie ze wszystkimi rodzajami elektrod jonowoselektywnych.
Czułość elektrod.
Elektrody jonowoselektywne odpowiadają na zmiany zawartości oznaczanego jonu w szerokim zakresie zawartości od stężeń jednomolowych do stężeń rzędu 10-6m. i mniejszych. Mniejsza granica czułości jest określona przez rozpuszczalność krystalicznego elementu czujnikowego (dla elektrod ze stałą membraną nieorganiczną) lub tworzenie się związków kompleksowych (dla elektrod z membraną PVC) w czystej wodzie, przy czym ma to różny charakter dla różnych elektrod. Teoretycznie, górna granica czułości jest określona przez wartości w stanie nasycenia. Elementy czujnikowe niektórych elektrod rozpuszczają się jednak w stężonych roztworach jednego z ich jonów, na przykład elementy czujnikowe zawierające halogenki srebra. Jako praktyczną górną granicę czułości podaje się stężenie10-1 M.
Wpływ pH
Większość elektrod jonowoselektywnych rozprowadzanych przez P.W.H."MARAT" nadaje się do stosowania w szerokim zakresie pH (od 2 do 12). Przy stosowaniu niektórych elektrod, na przykład elektrody miedziowej, element czujnikowy rozpuszcza się stopniowo w stężonych roztworach silnych kwasów.
W większości przypadków, wykorzystanie całego zakresu pH do bezpośrednich pomiarów potencjometrycznych nie jest możliwa, ponieważ duża liczba jonów tworzy przy różnych wartościach pH związki kompleksowe o różnym stopniu związania. Użyteczny zakres pH można wyznaczyć za pomocą obliczeń, w których jony H+ i OH- przyjmuje się za jony zakłócające, lub przez pomiar potencjały elektrod jonowoselektywnych w roztworze o stałej zawartości odpowiedniego jonu ale z różnymi wartościami pH. Odpowiednie zakresy pH dla różnych oznaczeń zostały podane w tablicy I. W przypadku elektrod stosujących wymieniacze jonów organicznych normalny zakres pH wynosi od 4 do 10.
Przy stosowaniu elektrod do miareczkowań potencjometrycznych, w niektórych przypadkach wymagana jest bardzo ostro stała wartość pH, podczas gdy w innych przypadkach wpływ różnych wartości pH jest ledwo zauważalny.
Trwałość użytkowa elektrod
Producent udziela sześciomiesięcznej gwarancji dla klasycznych typów elektrod jonowoselektywnych oraz dziewięciomiesięcznej gwarancji dla szklanych elektrod i elektrod odniesienia. Rzeczywisty okres trwałości elektrod sięga jednak jednego roku lub więcej.
Okres trwałości elektrod zależy nie tylko od sposobu obchodzenia się z nimi, ich traktowania, ale również od środowiska, w jakim są one wykorzystywane w celach pomiaru próbek. Z zasady należy wykluczyć próbki o dużym stopniu zanieczyszczenia, ponieważ mogą one spowodować uszkodzenie membran (zwłaszcza w przypadku elektrod z membranami PVC) i zdecydowanie obniżyć trwałość użytkową elektrod. Tę trudność można łatwo pokonać przez stosowanie filtrowania próbek. Również nie zaleca się stosowania próbek zawierających cząstki lipofilowe, które wykazując tendencję do pokrywania powierzchni membrany (zwłaszcza w przypadku elektrod z tworzyw sztucznych) mogą całkowicie zniweczyć pomiary. Warstewkę cząstek lipofilowych można ze stałych i szklanych membran usunąć za pomocą roztworów mydlanych, na ogół bez poważnego uszkodzenia elektrod. Proces ten może jednak poważnie naruszać membrany plastikowe, zmniejszając ich trwałość, pogarszając funkcjonalność lub nawet doprowadzić do zniszczenia. W niektórych środowiskach bezwodnych można stosować elektrody ze stałą membraną, podobnie jak szklane elektrody. Elektrody te można również stosować w częściowo bezwodnych środowiskach. Stosowanie elektrod jonowoselektywnych w agresywnych roztworach organicznych powinno się odbywać po konsultacji z producentem. Elektrody z membranami z PVC nie nadają się do stosowania w środowiskach bezwodnych. Ich stosowanie w częściowo bezwodnych środowiskach może spowodować zmniejszenie trwałości, aż do utraty funkcjonalności włącznie.
Znaczny wpływ na trwałość użytkową elektrod jonowoselektywnych mogą wywierać jony, które są obecne w analizowanych roztworach. Jony takie tworzą bardzo trudno rozpuszczalne, trudne do wydzielenia i/lub bardzo trwałe związki kompleksowe z materiałami elementu czujnikowego i mogą szkodzić funkcjonalności elektrody lub nawet spowodować jej całkowite zniszczenie.
Sposób pracy z elektrodami
Podczas wykonywania pomiaru, elektrody jonowoselektywne oraz zewnętrzna elektroda odniesienia są zanurzone w testowanym roztworze. Wytworzoną w ten sposób siłę elektromotoryczną ogniwa można zmierzyć za pomocą czułego przyrządu pomiarowego do mierzenia pH/mV, w którym opór wejścia jest dostatecznie duży.
Przy przeprowadzaniu pomiarów z zastosowaniem metody potencjometrii bezpośredniej wskazane jest dokonanie modyfikacji roztworów wzorcowych jak również mierzonych próbek, za pomocą odpowiedniego obojętnego roztworu, w taki sposób, by osiągnąć zrównanie mocy jonowej tak w próbkach mierzonych, jak i w próbkach wzorcowych.
Przed pomiarami należy koniecznie właściwie przygotować elektrody jonowoselektywne za pomocą odpowiedniej obróbki. Sposoby przygotowania, wykonywania pomiarów i zabezpieczenie elektrod serii 21, 23, 29, 35 i 37 oraz elektrod odniesienia różnią się między sobą w zależności od typu.
Seria 21 ma szklaną membranę ze specjalnego szkła. Najlepszym sposobem jest zanurzenie elektrody do roztworu jonowego, na który ona jest czuła, tj. w przypadku elektrody do mierzenia pH zanurzenie jej do buforowego roztworu fosforanowego, o wartości pH równej około 7, na okres około 24 godzin przed wykonaniem pomiaru. Również elektroda sodowa wymaga zanurzenia do wzorcowego roztworu z zawartością jonu sodowego około 10-3M. Na okres 24 godzin przed wykonaniem pomiaru. Do przygotowania roztworu należy użyć wody destylowanej lub redestylowanej.
Praca z elektrodami serii 23 jest bardziej skomplikowana niż z innymi rodzajami elektrod i jest opisana szczegółowo w odpowiednich podręcznikach tych elektrod. Na ogół do elementu wewnętrznego stosuje się te same zasady jak w przypadku elektrod serii 21, z tym jednak, że bufory do nasączania są dostarczane oddzielnie (jako elementy dodatkowego wyposażenia). Elektrody obu serii, tj. 21 i 23. po nasączeniu pozostają w sposób ciągły zanurzone jako zabezpieczenie przed wyschnięciem. Do elektrod serii 29 stosuje się także wszystkie zasady i uwagi przytoczone dla elektrod serii 21 i dla elektrod odniesienia.
Elektrody serii 35 mają membrany z tworzywa sztucznego. Przed zastosowaniem do pomiarów elektrody te muszą być przygotowane przez zanurzenie ich w odpowiednim roztworze wzorcującym o zawartości mierzonego jonu równej 10-3 mola/litr. Po wykonaniu pomiaru elektrodę należy umyć w wodzie destylowanej i z powrotem włożyć do roztworu wzorcującego. W przypadku dłuższych przerw pomiędzy pomiarami (trwających dłużej niż 1 tydzień) elektrodę należy umyć i przechowywać w skrzynce.
Membrany elektrod serii 37 są wykonane ze stałej substancji nieorganicznej. Wystarczy zanurzyć te elektrody w odpowiednim roztworze wzorcującym, z zawartością mierzonych jonów równą 10-3mola/litr na okres 3 godzin przed wykonaniem pomiaru. Po wykonaniu pomiaru, elektrodę należy umyć w wodzie destylowanej, wysuszyć i schować do odpowiedniego miejsca. Elektrody odniesienia trzeba zanurzyć do takiego samego elektrolitu, którym jest napełniony mostek solny (w przypadku dwumostkowych tym mostkiem jest dolny mostek solny) na okres około 24 godzin przed wykonaniem pomiaru. Konserwacja elektrod odniesienia polega na uzupełnianiu zawartości mostka solnego. Dwumostkowe elektrody odniesienia wymagają oprócz uzupełnienia zawartości mostka solnego, również wymiany zawartości drugiego mostka solnego. Wartości stężeń roztworów, które mają być stosowane do uzupełniania zawartości mostków elektrod odniesienia, są podane w podręcznikach dotyczących poszczególnych elektrod.
|

